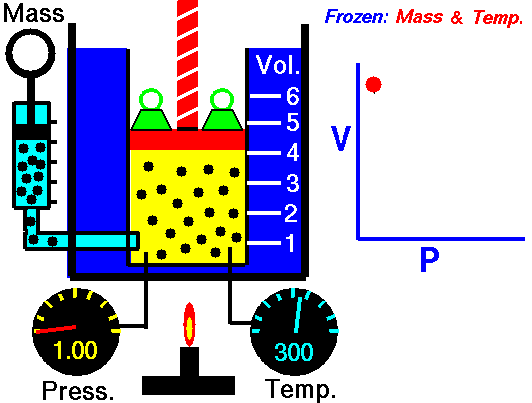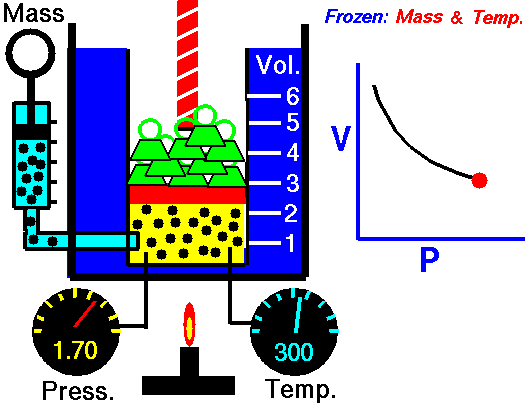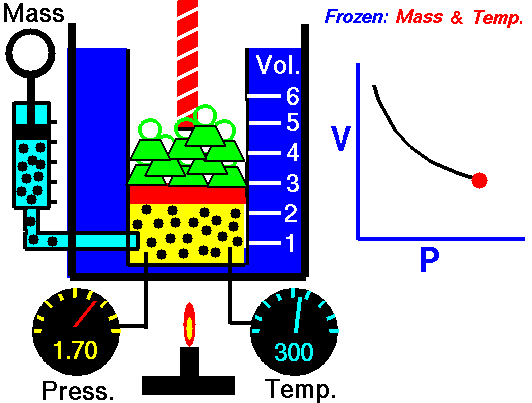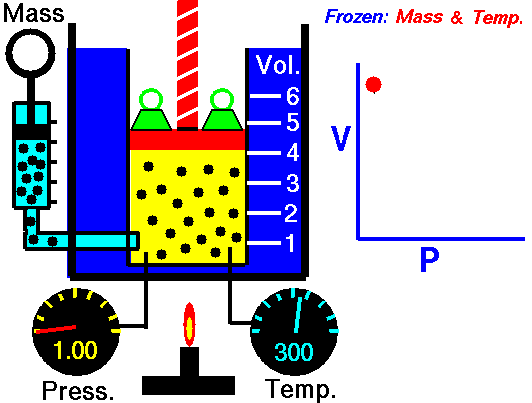
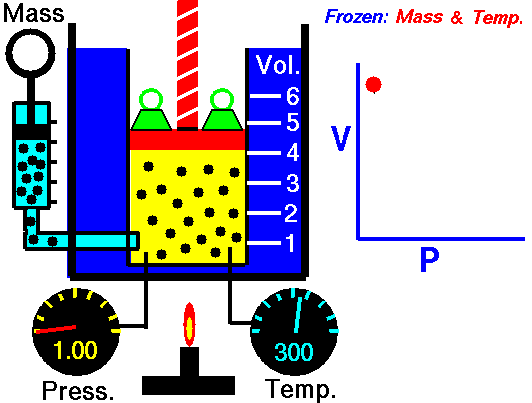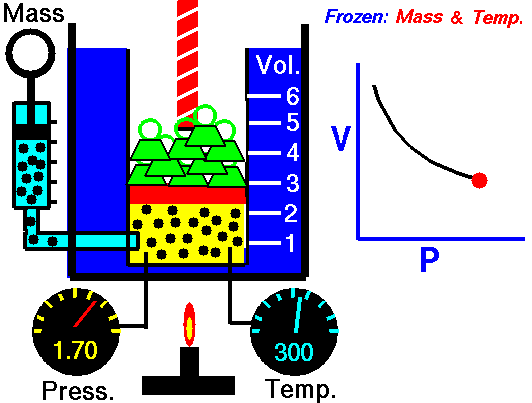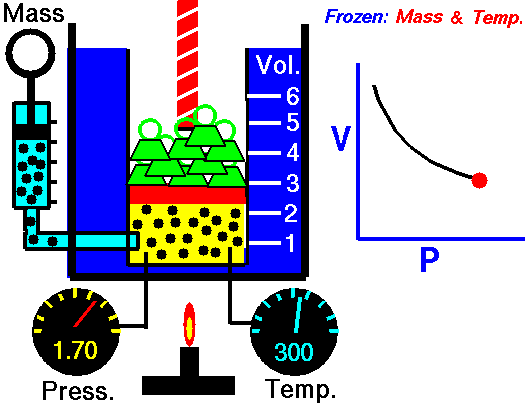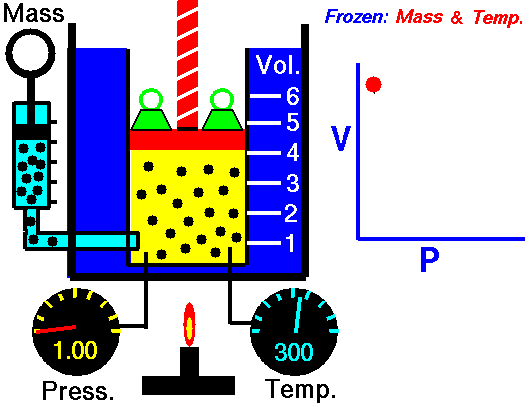
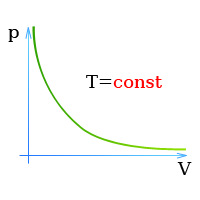
قانون بویل ماریو یکی از قوانین گاز است که:
برای جرم ثابت گاز در دمای ثابت، حجم با فشار نسبت معکوس دارد.
قانون بویل ماریوت یکی از قوانین گاز است. در پایان قرن هفدهم، رابرت ویلیام بویل و ادمه ماریوت به طور مستقل رابطه بین حجم و فشار را در دمای ثابت مطالعه کردند . نتایج آزمایشهای خاص با گازها در فشار نسبتاً کم، رابرت بویل را به تدوین قانون معروفی واداشت. بیان می کند که:
برای جرم ثابت گاز در دمای ثابت، حجم با فشار نسبت معکوس دارد.
یعنی مثلا اگر ولوم را 10 برابر کنید فشار 10 برابر کاهش می یابد. اگر حجم را نصف کنید فشار را دو برابر می کنید.
شما می توانید این را به صورت ریاضی بیان کنید:
pV = ثابت
یا
p 1 V 1 = p 2 V 2
بله، به نظر می رسد که با فرآیند همدما یک گاز ایده آل یکسان است. در واقع، در طول آزمایشات آنها، همانطور که ماریوته فرض کرده بود، دما ثابت می ماند. این نتایج کاملاً با قانون گاز ایده آل مطابقت دارد که تعیین می کند که ثابت برابر با nRT است .
pV = nRT
جایی که:
- p فشار مطلق گاز است
- n مقدار ماده است
- T دمای مطلق است
- V حجم است
- R ثابت گاز ایده آل یا جهانی است که برابر با حاصلضرب ثابت بولتزمن و ثابت آووگادرو است.
در این معادله، نماد R ثابت گاز جهانی است که مقدار یکسانی برای همه گازها دارد - یعنی R = 8.31 J/mol K.
برای جرم ثابت گاز در دمای ثابت، حجم با فشار نسبت معکوس دارد. منبع: grc.nasa.gov خط مشی حق چاپ ناسا بیان می کند که "مواد ناسا توسط حق چاپ محافظت نمی شود مگر اینکه ذکر شود".
 در این وبلاگ شما با ریاضی در سطوح مختلف آشنا خواهید شد.
در این وبلاگ شما با ریاضی در سطوح مختلف آشنا خواهید شد.